ОБЩИЕ СВЕДЕНИЯ
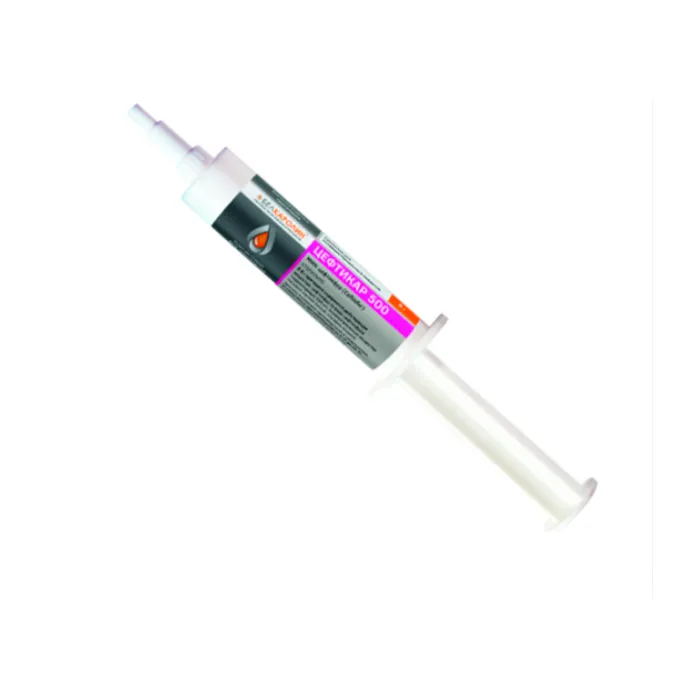
1.1 Цефтикар 500 (Cephthicarum 500).
Международное непатентованное наименование активной фармацевтической субстанции: цефтиофур (ceftiofur).
1.2 Лекарственная форма — суспензия для интрацистернального введения.
1.3 В 8 г препарата содержится действующее вещество: цефтиофур (в виде цефтиофура гидрохлорида) 500 мг и вспомогательные вещества: парафин мягкий белый, парафин жидкий.
1.4 Препарат представляет собой суспензию от серо-белого до светло-желтого цвета.
1.5 Препарат фасуют в одноразовые полимерные шприцы, укупоренные колпачками, по 8 г.
1.6 Препарат хранят в защищенном от света месте при температуре от 2 °C до 25 °C.
Хранить в недоступном для детей месте!
1.7 Срок годности 2 (два) года от даты производства при соблюдении условий хранения и транспортирования.
Запрещается применять по истечении срока годности.
Препарат уничтожают в соответствии с требованиями законодательства.
1.8 Отпускается без рецепта ветеринарного врача.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
2.1 Цефтикар 500 — антибактериальный препарат группы цефалоспоринов для интрацистернального применения.
2.2 Цефтиофур — цефалоспориновый антибиотик 3 поколения, обладает широким спектром антибактериального действия, активен в отношении грамположительных {Streptococcus spp., Staphylococcus spp., Trueperella pyogenes, Bacillus spp.) и грамотрицательных {Salmonella spp., Klebsiella spp., Escherichia coli, Pasteurella spp., Mannheimia haemolytica, Haemophilus spp., Citrobacter spp., Enterobacter spp., Proteus spp., Fusobacterium necrophorum) микроорганизмов, включая штаммы, продуцирующие β-лактамазу.
2.3 Механизм антибактериального действия цефтиофура заключается в ингибировании фермента транспептидазы и нарушении синтеза пептидогликана — мукопептида клеточной стенки, что приводит к нарушению роста клеточной стенки микроорганизма и лизису бактерий.
2.4 После введения цефтиофур подвергается метаболизму с образованием десфуроилцефтиофура, который обладает эквивалентной цефтиофуру активностью в отношении бактерий.
Активность препарата не снижается в присутствии некротизированных тканей.
Практически не оказывает системного действия.
После введения концентрация цефтиофура сохраняется на высоком терапевтическом уровне до 30 суток.
Выводится цефтиофур и его метаболиты из организма животного преимущественно с молоком.
2.5 Препарат по степени воздействия на организм относится к веществам малоопасным (4 класс опасности по ГОСТ 12.1.007-76). Не оказывает раздражающее действие на слизистые оболочки.
ПОРЯДОК ПРИМЕНЕНИЯ ВЕТЕРИНАРНОГО ПРЕПАРАТА
3.1 Цефтикар 500 применяют для одномоментного запуска коров, а также для лечения коров при субклиническом мастите в сухостойный период.
3.2 Препарат вводят интрацистернально в каждую четверть вымени однократно после последней дойки перед переводом в сухостойный период, не позднее, чем за 30 суток до предполагаемого отела, в дозе 8 г на четверть вымени.
3.3 Перед применением препарата молоко полностью выдаивают, сосок обрабатывают антисептическим препаратом.
Наконечник шприца помещают в канал соска и осторожно выдавливают содержимое в четверть вымени.
Вынимают шприц и пальцами пережимают сосок.
Проводят легкий массаж соска снизу-вверх для лучшего распределения препарата.
3.4 При соблюдении дозы, препарат побочных явлений не вызывает.
У чувствительных к компонентам лекарственного средства животных возможны аллергические реакции, которые проявляются в виде крапивницы и зуда кожи.
В этом случае следует назначить антигистаминные препараты и препараты кальция.
3.5 Противопоказано применять препарат животным с индивидуальной чувствительностью к цефалоспориновым и другим β-лактамным антибиотикам.
3.6 Запрещается применять препарат лактирующим животным, менее чем за 30 суток до предполагаемого отела; совместно с антибиотиками тетрациклиновой группы, макролидами, амфениколами и линкозамидами, так как это ведет к снижению терапевтической эффективности.
3.7 Молоко, полученное от лактирующих коров, может применятся в пищевых целях не ранее, чем через 30 суток после введения препарата.
Молоко, полученное ранее установленного срока, можно использовать в корм животным после термической обработки.
3.8 Убой животных на мясо разрешается не ранее чем через 16 суток после введения препарата.
В случае вынужденного убоя ранее установленного срока, продукты убоя допускается использовать в корм плотоядным животным.
МЕРЫ ЛИЧНОЙ ПРОФИЛАКТИКИ
4.1 При работе с препаратом следует соблюдать правила личной гигиены и техники безопасности.
ПОРЯДОК ПРЕДЪЯВЛЕНИЯ РЕКЛАМАЦИЙ
5.1 В случае возникновения осложнений после применения препарата, его использование прекращают и потребитель обращается в государственное ветеринарное учреждение, на территории которого он находится.
5.2 Ветеринарными специалистами этого учреждения производится изучение соблюдения всех правил применения этого препарата в соответствии с инструкцией.
При подтверждении выявления отрицательного воздействия препарата на организм животного, ветеринарными специалистами отбираются пробы в необходимом количестве для проведения лабораторных испытаний, оформляется акт отбора проб и направляется в государственное учреждение «Белорусский государственный ветеринарный центр» (220005, г. Минск, ул. Красная, 19А) для подтверждения соответствия нормативным документам.
ПОЛНОЕ НАИМЕНОВАНИЕ ИЗГОТОВИТЕЛЯ
6.1 Общество с ограниченной ответственностью «Белкаролин», Республика Беларусь, 210101, г. Витебск, ул. Экономическая, 16.
Адрес производственной площадки: 210033, г. Витебск, пр-т. Фрунзе, 81/31.